FastKing One Step RT-PCR Kit
سمات
■ نقاء: يتم إكمال النسخ العكسي وتفاعلات تفاعل البوليميراز المتسلسل في خطوة واحدة لتجنب التلوث المتبادل.
■ كفاءة عالية: نسخة فريدة عكسية من King مع كفاءة RT تزيد عن 95٪.
■ حساس: يمكن تحديد نماذج أقل من 1 نانوغرام بدقة ، خاصة للقوالب ذات الوفرة المنخفضة.
الخصوصية: إن بوليميراز Taq المعدل بالأجسام المضادة يحسن من كفاءة وخصوصية التضخيم.
التطبيقات
إنها مناسبة للكشف عن مستوى التعبير الجيني في الخلايا والأنسجة ، واستنساخ جينات معينة والكشف عن فيروس الحمض النووي الريبي. إنها مناسبة بشكل خاص للكشف النوعي عن القوالب ذات الوفرة المنخفضة.
يمكن تخصيص جميع المنتجات لـ ODM / OEM. للتفاصيل،الرجاء النقر فوق خدمة مخصصة (ODM / OEM)
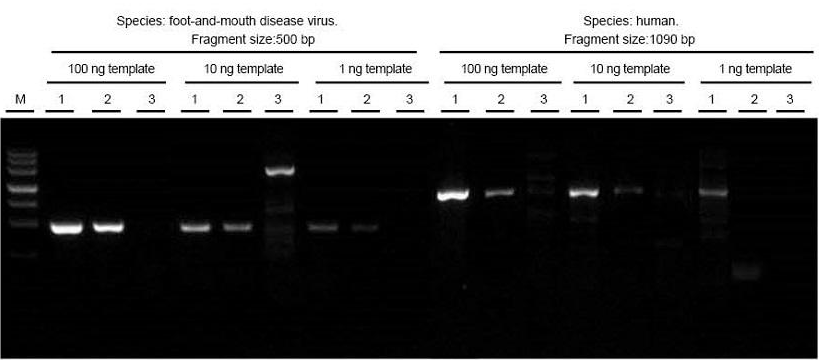 |
تم استخراج مجموع الحمض النووي الريبي لفيروس مرض الحمى القلاعية وعينات الأنسجة البشرية على التوالي. النسخ العكسي و PCR الأجزاء المستهدفة ذات الأطوال المختلفة باستخدام TIANGEN FastKing One Step RT-PCR Kit (1) ، والمنتجات ذات الصلة من المورد A (2) والمورد B (3) ومراقبة منتجات PCR بعد الرحلان الكهربائي. تظهر النتائج أن نطاق FastKing One Step RT-PCR Kit واضح ومشرق ، مع عدم وجود ذيل ولا نطاقات غير محددة ، ويمكن اكتشاف قالب 1 نانوغرام جيدًا. النتائج التجريبية لـ TIANGEN أفضل من تلك الخاصة بالمنتجات ذات الصلة. |
A-1 RNA متدهورة
—— تنقية الحمض النووي الريبي عالي الجودة بدون تلوث. يجب أن تكون المادة التي يتم استخراج الحمض النووي الريبي منها طازجة قدر الإمكان لمنع تدهور الحمض النووي الريبي. تحليل سلامة الحمض النووي الريبي على هلام التحريف الصفات قبل رد فعل RT. بعد استخراج الحمض النووي الريبي ، يجب تخزينه في فورماميد 100٪. إذا تم استخدام مثبط RNase ، يجب أن تكون درجة حرارة التسخين أقل من 45 درجة مئوية ، ويجب أن يكون الأس الهيدروجيني أقل من 8.0 ، وإلا فإن المثبط سيطلق كل RNase المرتبط. علاوة على ذلك ، يجب إضافة مثبط RNase في محاليل تحتوي على ≥ 0.8 ملي مولار DTT.
يحتوي A-2 RNA على مثبطات تفاعلات النسخ العكسي
—— تشمل مثبطات النسخ العكسي SDS ، EDTA ، الجلسرين ، بيروفوسفات الصوديوم ، سبيرميدين ، فورماميد ، ملح الجوانيدين ، إلخ. امزج RNA الضبط مع العينة ، وقارن العائد مع تفاعل RNA للتحكم للتحقق مما إذا كان هناك مثبط. اغسل ترسيب الحمض النووي الريبي مع 70٪ (حجم / حجم) إيثانول لإزالة المثبطات.
A-3 التلدين غير الكافي للبادئات المستخدمة لتركيب الخيط الأول من (كدنا)
—— تحديد أن درجة حرارة التلدين مناسبة للبادئات المستخدمة في التجربة. بالنسبة للسداسيات العشوائية ، يوصى بالحفاظ على درجة الحرارة عند 25 درجة مئوية لمدة 10 دقائق قبل الوصول إلى درجة حرارة التفاعل. بالنسبة للبادئات الخاصة بالجينات (GSP) ، جرب GSP أخرى ، أو قم بالتبديل إلى oligo (dT) أو السداسي العشوائي.
A-4 كمية صغيرة من بدء RNA
- زيادة كمية الحمض النووي الريبي. بالنسبة لعينات الحمض النووي الريبي التي تقل عن 50 نانوغرام ، يمكن استخدام 0.1 ميكروغرام إلى 0.5 ميكروغرام من أسيتيل BSA في أول تخليق جديلة (كدنا)
أ -5 لا يتم التعبير عن التسلسل المستهدف في الأنسجة التي تم تحليلها.
—— جرب الأنسجة الأخرى.
فشل تفاعل A-6 PCR
—— للحصول على RT-PCR من خطوتين ، لا يمكن أن يتجاوز قالب (كدنا) في الخطوة PCR 1/5 من حجم التفاعل.
أ -1 التلدين غير النوعي للبادئات والقوالب
—— يجب ألا يحتوي الطرف 3'-نهاية من البادئات على 2-3 دي جي أو دي سي. استخدم البادئات الخاصة بالجينات في تركيب الخيط الأول بدلاً من البادئات العشوائية أو الأوليغو (dT). استخدم درجة حرارة تلدين أعلى في الدورات القليلة الأولى ، ثم درجة حرارة تلدين أقل. استخدم بوليميراز DNA Taq ذي البداية الساخنة لـ PCR لتحسين خصوصية التفاعل.
أ -2 سوء تصميم البادئات الخاصة بالجينات
—— اتبع نفس المبادئ لتصميم التمهيدي التضخيم.
A-3 RNA ملوث بالحمض النووي الجيني
—— علاج الحمض النووي الريبي باستخدام DNase الصف PCR 1. قم بإعداد تفاعل تحكم بدون النسخ العكسي للكشف عن تلوث الحمض النووي.
A-4 تشكيل ديمر التمهيدي
—— تصميم الاشعال بدون تسلسلات تكميلية في نهاية 3 '.
أ -5 عالية جدا ملغ2+ تركيز
——Optimize Mg2+ التركيز لكل قالب وتركيبة التمهيدي
A-6 ملوثة بالحمض النووي الأجنبي
—— استخدام أطراف مقاومة للهباء الجوي وإنزيمات UDG.
A-1 محتوى منتج الخصلة الأول مرتفع جدًا
—— قم بتقليل كمية أول منتج حبلا في خطوة تفاعل تفاعل البوليميراز المتسلسل التقليدية.
A-2 كمية عالية جدا من التمهيدي في تفاعل PCR
—— تقليل إدخال التمهيدي.
أ -3 دورات كثيرة جدًا
—— تحسين ظروف تفاعل تفاعل البوليميراز المتسلسل وتقليل عدد دورة تفاعل البوليميراز المتسلسل.
A-4 درجة حرارة تلدين منخفضة للغاية
—— زيادة درجة حرارة التلدين لمنع البدء والتمدد غير المحدد.
أ -5 التضخيم غير النوعي لشظايا قليل النوكليوتيد المتولدة عن تحلل الدنايز للحمض النووي - استخراج الحمض النووي الريبي عالي الجودة لمنع تلوث الحمض النووي.
RT-PCR هو عكس نسخ الحمض النووي الريبي إلى (كدنا) ، ثم استخدام نسخة عكسية (كدنا) كقالب لتفاعل تفاعل البوليميراز المتسلسل لتضخيم الجزء المستهدف. اختر إما البادئات العشوائية ، Oligo dT والبادئات الخاصة بالجينات وفقًا للظروف المحددة للتجربة. يمكن استخدام جميع البادئات المذكورة أعلاه في mRNA قصير الخلية حقيقية النواة بدون بنية دبوس الشعر.
التمهيدي العشوائي: مناسب للـ RNA الطويل بهيكل دبوس الشعر ، وكذلك جميع أنواع الحمض النووي الريبي مثل rRNA ، و mRNA ، و tRNA ، إلخ. وهي تستخدم بشكل أساسي لتفاعل RT-PCR لقالب واحد.
Oligo dT: مناسب لـ RNA مع ذيل PolyA (الحمض النووي الريبي بدائية النواة ، وحقيقية النواة Oligo dT rRNA و tRNA لا يحتويان على ذيول PolyA). نظرًا لأن Oligo dT مرتبط بذيل PolyA ، يجب أن تكون جودة عينات الحمض النووي الريبي عالية ، وحتى كمية صغيرة من التحلل ستقلل بشكل كبير من كمية تخليق (كدنا) كامل الطول.
التمهيدي الخاص بالجينات: مكمل لتسلسل القالب ، ومناسب للحالات التي يكون فيها التسلسل المستهدف معروفًا.
هناك طريقتان:
1. طريقة المرجع الداخلي: من الناحية النظرية ، cDNA عبارة عن شظايا DNA ذات أطوال مختلفة ، وبالتالي فإن نتيجة الرحلان الكهربائي هي اللطاخة. إذا كانت وفرة الحمض النووي الريبي منخفضة ، فلن يظهر أي منتج في الرحلان الكهربائي ، لكن هذا لا يعني أنه لن يتم تضخيم أي منتج بواسطة تفاعل البوليميراز المتسلسل. بشكل عام ، يمكن استخدام المرجع الداخلي للكشف عن [كدنا]. إذا كان للمرجع الداخلي نتائج ، فيمكن ضمان جودة cDNA بشكل أساسي (في حالات قليلة ، إذا كان جزء الجين المستهدف طويلاً جدًا ، فقد تكون هناك استثناءات).
2. إذا كان هناك جين معروف تم تضخيمه بواسطة هذا القالب ، فيمكن التحقق منه بواسطة بادئات هذا الجين. لا يعني تضخيم المرجع الداخلي بالضرورة أنه لا توجد مشكلة في [كدنا]. نظرًا لأن المرجع الداخلي يحتوي على وفرة عالية في (كدنا) ، فمن السهل تضخيمه. إذا تم تدهور cDNA جزئيًا لأسباب مختلفة ، من منظور الاحتمال ، فإن نتائج PCR للجينات المستهدفة ذات الوفرة المنخفضة سوف تتأثر بشكل كبير. في حين أن المرجع الداخلي لا يزال مرتفعًا في الوفرة ، فمن المحتمل ألا يتأثر التضخيم.
تحلل جزئيًا من الحمض النووي الريبي. الكشف عن سلامة وتنقية الحمض النووي الريبي
قد تختلف محتويات الحمض النووي الريبي للأنواع المختلفة ، ولكن بشكل عام ، يجب أن يحتوي إجمالي الحمض النووي الريبي المستخرج على نطاقي 28S و 18S في الرحلان الكهربي للهلام ، ويجب أن يكون سطوع النطاق السابق أعلى بمرتين من سطوع الأخير. يشير النطاق 5S إلى أن الحمض النووي الريبي قد تدهور ، وأن سطوعه يتناسب مع درجة التدهور. لا يعني التضخيم الناجح للمرجع الداخلي أنه لا توجد مشكلة في الحمض النووي الريبي ، لأن المرجع الداخلي في وفرة عالية ، يمكن تضخيم الحمض النووي الريبي طالما أن التدهور ليس شديدًا. OD260/ التطوير التنظيمي280يجب أن تكون نسبة الحمض النووي الريبي النقي المقاسة بمقياس الطيف الضوئي بين 1.9 و 2.1. كمية صغيرة من شوائب البروتين في الحمض النووي الريبي ستقلل النسبة. طالما أن القيمة ليست منخفضة جدًا ، فلن تتأثر RT. أكثر ما يهم RT هو سلامة الحمض النووي الريبي.
يمكن أن يشير امتداد الجين المرجعي الداخلي فقط إلى أن RT قد نجح ، لكنه لا يرتبط بالضرورة بجودة حبلا cDNA. نظرًا لأن الأجزاء المرجعية الداخلية صغيرة الحجم بشكل عام وعالية التعبير ، فمن الأسهل أن تنجح في النسخ العكسي. ومع ذلك ، فإن حجم الجين المستهدف والتعبير عنه يختلف من جين إلى آخر. لا يمكن الحكم على جودة (كدنا) إلا من خلال المرجع الداخلي خاصة بالنسبة للأجزاء المستهدفة التي يزيد طولها عن 2 كيلو بايت.
تحتوي بعض العينات على هياكل ثانوية معقدة ، أو تحتوي على محتوى غني من GC ، أو تكون ثمينة مع وفرة منخفضة. في هذه الحالات ، يجب اختيار النسخ العكسي المناسب وفقًا لحجم الجزء المستهدف والعينة. بالنسبة لقوالب الحمض النووي الريبي ذات المحتوى العالي من GC والبنية الثانوية المعقدة ، من الصعب فتح الهيكل الثانوي عند درجة حرارة منخفضة ، أو باستخدام النسخ العكسي المشترك. بالنسبة لهذه القوالب ، يمكن تحديد النسخ العكسي الكمي ، نظرًا لأن أداء النسخ العكسي أفضل بشكل واضح من أداء النسخ العكسي لسلسلة M-MLV ، والذي يمكنه عكس نسخ قوالب RNA المختلفة بكفاءة ونسخ RNA إلى cDNA أول حبلا إلى أقصى حد. عند استخدام مجموعة النسخ العكسي العامة ، يمكن لنظام 20 ميكرولتر فقط عكس نسخ 1 ميكروغرام من إجمالي الحمض النووي الريبي بشكل فعال. يرجى الانتباه إلى أقصى سعة RT للمجموعة. إذا تمت إضافة القالب بشكل زائد ، فإن النسخ العكسي سيفضل RNA بكثرة. لذلك ، من الأفضل عدم تجاوز السعة القصوى للنظام.
A-1 تحديد ما إذا كان الحمض النووي الريبي يتحلل بشدة وما إذا كان RT ناجحًا
بشكل عام ، غالبًا ما يكون سبب فشل التضخيم المرجعي الداخلي هو التدهور الخطير للحمض النووي الريبي. سبب آخر محتمل هو فشل النسخ العكسي. لا يمكن استخدام المرجع الداخلي كمعيار للحكم على جودة الخيط الفردي (كدنا) ، ولكن يمكن استخدامه كمعيار للحكم على ما إذا كان النسخ العكسي ناجحًا إذا لم تكن هناك مشكلة في جودة الحمض النووي الريبي. أهم شيء في عملية النسخ العكسي هو الحفاظ على درجة حرارة ثابتة ونظام تفاعل ثابت من أجل تحسين كفاءة التفاعل.
A-2 تحديد ما إذا كانت البادئات لتضخيم الجينات المرجعية الداخلية موثوقة وما إذا كانت هناك أي مشاكل مع الكواشف المستخدمة في تفاعل البوليميراز المتسلسل.
من أجل القياس الكمي النسبي ، يجب تحديد كمية الحمض النووي الريبي قبل النسخ العكسي ، وهو أمر مطلوب أيضًا في العديد من مجموعات النسخ العكسي ، على سبيل المثال ، تحديد مدخلات الحمض النووي الريبي كـ 1 ميكروغرام. نظرًا لأن cDNA المنسوخ العكسي عبارة عن محلول مختلط ، بما في ذلك RNA و oligo dT والإنزيم و dNTP وحتى القليل من بقايا الحمض النووي ، فسيحدث الانحراف ، لذلك من المستحيل تحديد كمية cDNA بدقة. لذلك ، من الضروري تحديد كمية الحمض النووي الريبي. بالنظر إلى أن كفاءة النسخ العكسي هي نفسها بين العينات المختلفة ، يجب أن تكون كمية (كدنا) التي تم الحصول عليها هي نفسها ، ويمكن أن يُظهر التحليل الكمي مقارنة مستويات التعبير للجينات المختلفة بنفس المقدار من إجمالي الحمض النووي الريبي. عند إجراء PCR الكمي الفلوري النسبي ، قد لا تكون (كدنا) مطلوبة بعد النسخ العكسي لأن الجين المرجعي الداخلي يمكن أن يعمل كمرجع.
إنه مرتبط بشكل أساسي بالجينات ، والنسخ العكسي للجزء الطويل غير ممكن لمعظم الجينات. أولاً ، كفاءة النسخ العكسي أقل بكثير من فعالية PCR. ثانيًا ، تقيد منطقة GC الغنية والبنية الثانوية للعديد من الجينات كلا من النسخ العكسي و PCR. أخيرًا ، يصعب ضمان دقة الإخلاص وكفاءة التضخيم لـ PCR في نفس الوقت. في عملية النسخ العكسي ، لا يمكن لأحد أن يضمن الحصول على جزء طويل لجينات النسخ المنخفضة ، خاصة باستخدام oligo dT. أما بالنسبة لـ 5 'UTR مع المزيد من GC ، فهو أكثر صعوبة. لذلك ، لا تزال طريقة معقولة لعكس النسخ باستخدام الاشعال العشوائي ، والعثور على مواقع الانقسام الطبيعي في الجزء المستهدف ، والتضخيم بواسطة المقاطع ، ثم إجراء عملية هضم التقييد والربط. بشكل عام ، من الصعب تضخيم الأجزاء التي يزيد حجمها عن 2 كيلو بايت بشكل مباشر ، ولكن ليس من المستحيل دائمًا الحصول عليها: 1. أولاً وقبل كل شيء ، ضمان سلامة RNA / mRNA ، ويفضل استخراج TRIZOL. 2.يمكن استخدام مجموعة M-MLV RT-PCR مباشرة. تمديد وقت التلدين وزيادة رقم الدورة في عملية التضخيم بشكل صحيح. بدلاً من ذلك ، يمكن تطبيق تفاعل البوليميراز المتسلسل المتداخل ، أو تنفيذ تفاعل أو تفاعلين أولاً مع تمسخ ممتد بشكل مناسب ووقت تمديد قبل تضخيم تفاعل البوليميراز المتسلسل العادي ، مما قد يساعد في تمديد الأجزاء. انتبه إلى دقة البوليميراز. يمكن استخدام 3.Long Taq في PCR للحصول على نتائج مثالية. 4. لتطبيق تعبير البروتين ، يجب تطبيق بوليميراز عالي الدقة.
هناك نوعان من النسخ العكسي التي تقدمها TIANGEN: Quant / King RTase و TIANScript M-MLV. الفرق الرئيسي بينهما هو مقدار إدخال القوالب. الكمية هي نسخة عكسية فريدة من نوعها ، والتي تختلف عن M-MLV المستخدمة بشكل شائع والمشتقة من فيروس سرطان الدم Moloney Murine. الكمية عبارة عن نسخة عكسية جديدة عالية الكفاءة تم التعبير عنها بشكل متجانس من قبل هندسة الإشريكية القولونية. الكمية مناسبة لتضخيم 50 نانوغرام -2 ميكروغرام من الحمض النووي الريبي مع نشاط نسخ عكسي عالي وعائد مرتفع. مقارنةً بـ MMLV أو AMV العاديين ، فإن أكبر ميزة لـ Quant هي أنها تمتلك تقاربًا قويًا جدًا مع قوالب RNA ويمكنها عكس القوالب المعقدة للنسخ دون تغيير درجة الحرارة العالية. بالنسبة للقوالب ذات المحتوى العالي من GC ، تكون الكفاءة العكسية أعلى. ومع ذلك ، فإن هذا النسخ العكسي يحتوي على نشاط RNase H ، والذي قد يؤثر على طول منتج cDNA (مناسب لقوالب <4.5 كيلو بايت). للنسخ العكسي التقليدي ، يوصى باستخدام النسخ العكسي TIANScript MMLV. إن إنزيم RTase هذا هو إنزيم معدل مع نشاط RNase H ضعيف جدًا ، وهو مناسب لتخليق cDNA الطويل (> 5 كيلو بايت).
يتم إكمال النسخ العكسي بخطوة واحدة وتضخيم PCR في نفس الأنبوب دون فتح غطاء الأنبوب بين تركيب (كدنا) والتضخيم ، مما يساعد على تقليل التلوث. نظرًا لاستخدام جميع عينات (كدنا) التي تم الحصول عليها للتضخيم ، تكون الحساسية أعلى ، بحد أدنى 0.01 بيكوغرام من إجمالي الحمض النووي الريبي. بالنسبة إلى RTPCR الناجح من خطوة واحدة ، تُستخدم البادئات الخاصة بالجينات بشكل عام لبدء تخليق (كدنا). يتم تنفيذ الطريقة المكونة من خطوتين ، وهي النسخ العكسي وتضخيم PCR في خطوتين. أولاً ، يتم إجراء النسخ العكسي من قالب RNA للحصول على (كدنا) ، ويتعرض (كدنا) الذي تم الحصول عليه لواحد أو أكثر من تفاعلات PCR المختلفة. يمكن أن تستخدم الطريقة المكونة من خطوتين oligo (dT) أو الاشعال العشوائي لتوجيه توليف أول خيط من cDNA ، ويمكن عكس نسخ جميع معلومات mRNA من عينة محددة.
فئات المنتجات
لماذا أخترتنا
منذ إنشائه ، يقوم مصنعنا بتطوير منتجات عالمية المستوى مع الالتزام بالمبدأ
الجودة أولا. اكتسبت منتجاتنا سمعة ممتازة في الصناعة والثقة القيمة بين العملاء الجدد والقدامى.