TIANSeq HiFi Amplification Mix
المصب
تضخيم PCR الخاص بمكتبة NGS ، تضخيم PCR المتسلسل من الجيل الأول ، الاستنساخ عالي الدقة ، اكتشاف SNP ، الطفرة الخاصة بالموقع ، إلخ.
سمات
■ تضخيم عالي الكفاءة: ضمان معدل التحويل وتقليل دورات التضخيم.
■ تفضيل منخفض: كفاءة تضخيم متوازنة لقوالب الحمض النووي بمحتويات GC٪ مختلفة.
■ خصوصية عالية: مع خاصية HotStart وخصوصية قوية.
■ دقة عالية: تبلغ الدقة 50 مرة أعلى من بوليميراز DNA Taq.
■ حساسية عالية: يمكن أن يصل إدخال النموذج إلى 1 بيكوغرام.
يمكن تخصيص جميع المنتجات لـ ODM / OEM. للتفاصيل،الرجاء النقر فوق خدمة مخصصة (ODM / OEM)
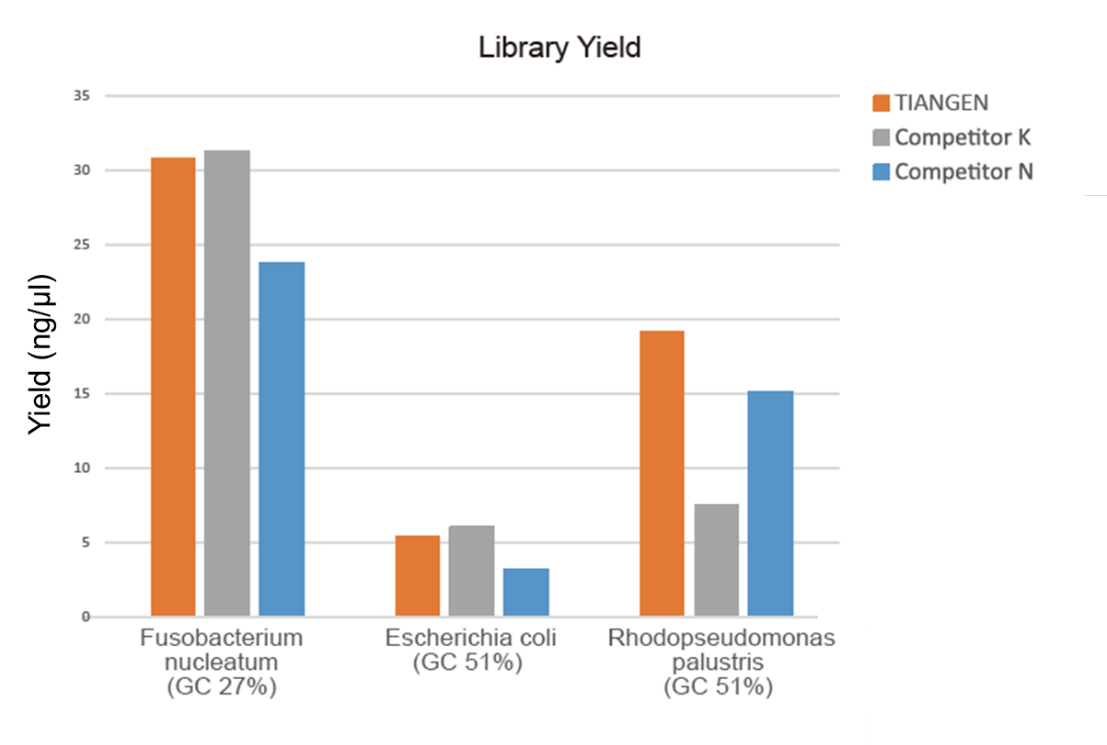 |
الشكل 1. تم إجراء إثراء المكتبة للحمض النووي الجينومي بنسب GC مختلفة (إدخال الجينوم 10 نانوغرام ، تضخيم 8 دورات) في وقت واحد باستخدام TIANSeq HiFi Amplification Mix وإنزيم HiFi من المورد K و N ، وتم اكتشاف عائد المكتبة بواسطة Agilent 2100. أظهرت النتائج أن TIANSeq HiFi Amplification Mix لها عائد مكتبة مرتفع ، مع عالمية قوية لمحتويات GC المختلفة ، وكان أداء إثراء المكتبة أفضل من الموردين الآخرين. |
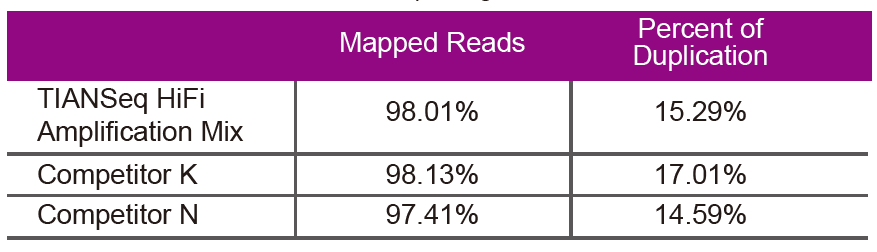 |
تسلسل البياناتاستخدم TIANSeq HiFi Amplification Mix وإنزيم HiFi المستخدم خصيصًا لتضخيم مكتبة NGS من المورد K و N لتضخيم المكتبة لنفس الحمض النووي الجيني (إدخال الجينوم هو 10 نانوغرام). بعد التسلسل ، قم بتحليل التغطية ومعدل الازدواجية للمكتبة. |
تفضيل GC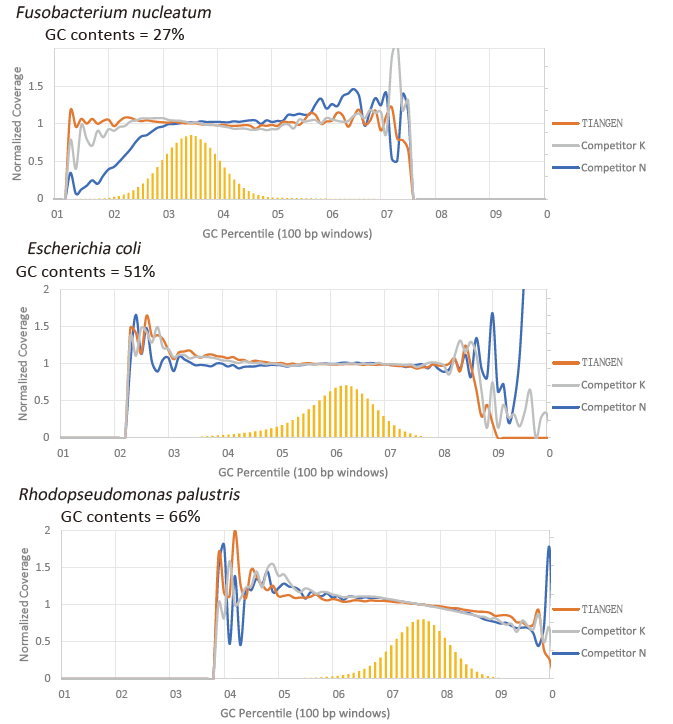 |
الشكل 2. تضخيم مكتبات الجينوم بمحتويات CG المختلفة باستخدام TIANSeq HiFi Amplification Mix و HIFi من المورد K و N. تظهر النتيجة أن توحيد مكتبة تضخيم TIANSeq HiFi Amplification Mix جيد وبدون تفضيل GC ، وهو ما يعادل النتائج من الشركة K وأفضل قليلاً من منتجات الشركة N. أظهرت النتائج أن تغطية مكتبة TIANSeq HiFi Amplification Mix للتضخيم عالية ، ومعدل النسخ يلبي المتطلبات ، وأداء التضخيم للمكتبة يعادل تلك الخاصة بالمنافسين. |
في الوقت الحاضر ، تعتمد تقنية التسلسل عالي الإنتاجية بشكل أساسي على تقنية تسلسل الجيل التالي. نظرًا لأن طول القراءة لتقنية تسلسل الجيل التالي محدود ، يجب علينا تقسيم التسلسل الكامل إلى مكتبات أجزاء صغيرة للتسلسل. وفقًا لاحتياجات تجارب التسلسل المختلفة ، نختار عادةً التسلسل أحادي الطرف أو التسلسل مزدوج النهاية. حاليًا ، يتم توزيع أجزاء الحمض النووي لمكتبة تسلسل الجيل التالي بشكل عام في نطاق 200-800 نقطة أساس.

أ) الحمض النووي رديء الجودة ويحتوي على مثبطات. استخدم عينات DNA عالية الجودة لتجنب تثبيط نشاط الإنزيم.
ب) كمية عينة الحمض النووي غير كافية عند استخدام طريقة خالية من تفاعل البوليميراز المتسلسل لإنشاء مكتبة DNA. عندما يتجاوز إدخال الحمض النووي المجزأ 50 نانوغرام ، يمكن تنفيذ سير العمل الخالي من تفاعل البوليميراز المتسلسل بشكل انتقائي أثناء عملية بناء المكتبة. إذا كان عدد نسخ المكتبة منخفضًا جدًا بحيث لا يمكن إجراء تسلسل مباشر له ، فيمكن تضخيم مكتبة الحمض النووي بواسطة تفاعل البوليميراز المتسلسل بعد ربط المحول.
ج) يؤدي تلوث الحمض النووي الريبي (RNA) إلى تقدير غير دقيق للحمض النووي الريبي (DNA) وقد يوجد تلوث الحمض النووي الريبي في عملية تنقية الحمض النووي الجيني ، مما قد يؤدي إلى تقدير كمية غير دقيقة للحمض النووي وعدم كفاية تحميل الحمض النووي أثناء بناء المكتبة. يمكن إزالة الحمض النووي الريبي عن طريق العلاج باستخدام RNase.
أ -1
أ) تظهر شظايا صغيرة (60 نقطة أساس - 120 نقطة أساس) الشظايا الصغيرة عادة ما تكون شظايا محول أو ثنائيات مكونة من المحولات. يمكن للتنقية باستخدام حبات Agencourt AMPure XP المغناطيسية إزالة أجزاء المحول هذه بشكل فعال وضمان جودة التسلسل.
ب) تظهر شظايا كبيرة في المكتبة بعد تضخيم PCR. سيزداد حجم جزء الحمض النووي للمكتبة بمقدار 120 نقطة أساس بعد ربط المحول. إذا زاد جزء الحمض النووي بأكثر من 120 نقطة أساس بعد ربط المحول ، فقد يكون ناتجًا عن تضخيم شظي غير طبيعي لتضخيم PCR المفرط. يمكن أن يؤدي تقليل عدد دورات PCR إلى منع الموقف.
ج) الحجم غير الطبيعي لشظايا الحمض النووي للمكتبة بعد ربط المحول طول المحول في هذه المجموعة هو 60 نقطة أساس. عندما يتم ربط طرفي الجزء بالمحولات ، سيزداد الطول بمقدار 120 نقطة أساس فقط. عند استخدام محول غير الذي توفره هذه المجموعة ، يرجى الاتصال بالمورد لتقديم المعلومات ذات الصلة مثل طول المحول. يرجى التأكد من أن سير عمل التجربة والتشغيل يتبعان الخطوات الموضحة في الدليل.
د) حجم غير طبيعي لجزء الحمض النووي قبل ربط المحول قد يكون سبب هذه المشكلة بسبب ظروف رد فعل خاطئة أثناء تجزئة الحمض النووي. يجب استخدام أوقات تفاعل مختلفة لإدخال DNA مختلف. إذا كان إدخال الحمض النووي أكثر من 10 نانوغرام ، فإننا نوصي باختيار وقت رد الفعل البالغ 12 دقيقة كوقت بدء للتحسين ، ويكون حجم الجزء الناتج في هذا الوقت بشكل أساسي في نطاق 300-500 نقطة أساس. يمكن للمستخدمين زيادة أو تقليل طول أجزاء الحمض النووي لمدة 2-4 دقائق وفقًا لمتطلباتهم الخاصة لتحسين أجزاء الحمض النووي بالحجم المطلوب.
أ -2
أ) لم يتم تحسين وقت التجزئة إذا كان الحمض النووي المجزأ صغيرًا جدًا أو كبيرًا جدًا ، فيرجى الرجوع إلى المبادئ التوجيهية لاختيار وقت التجزئة الواردة في التعليمات لتحديد وقت رد الفعل ، واستخدام هذه النقطة الزمنية كعنصر تحكم ، بالإضافة إلى إعداد نظام رد فعل لإطالة أو تقصير 3 دقائق لإجراء تعديل أكثر دقة على وقت التجزئة.
أ -3
توزيع حجم غير طبيعي للحمض النووي بعد علاج التجزؤ
أ) طريقة إذابة غير صحيحة لكاشف التجزئة ، أو عدم خلط الكاشف بالكامل بعد الذوبان. قم بإذابة كاشف مزيج إنزيم التجزئة 5 × على الجليد. بمجرد الذوبان ، قم بخلط الكاشف بالتساوي عن طريق تحريك قاع الأنبوب برفق. لا تقم بتدوير الكاشف!
ب) تحتوي عينة إدخال الحمض النووي على EDTA أو ملوثات أخرى يعتبر استنفاد أيونات الملح والعوامل المخلبية في خطوة تنقية الحمض النووي مهمًا بشكل خاص لنجاح التجربة. إذا تم إذابة الحمض النووي في 1 × TE ، فاستخدم الطريقة الواردة في التعليمات لإجراء التجزئة. إذا كان تركيز EDTA في المحلول غير مؤكد ، يوصى بتنقية الحمض النووي وتذويبه في الماء منزوع الأيونات للتفاعل اللاحق.
ج) التقدير الكمي الأولي غير الدقيق للحمض النووي يرتبط حجم الحمض النووي المجزأ ارتباطًا وثيقًا بكمية إدخال الحمض النووي. قبل معالجة التجزئة ، يعد القياس الدقيق للحمض النووي باستخدام Qubit و Picogreen وطرق أخرى ضروريًا لتحديد الكمية الدقيقة للحمض النووي في نظام التفاعل.
د) لا يتبع إعداد نظام التفاعل التعليمات. يجب أن يتم إعداد نظام التفاعل المجزأ على الجليد بدقة وفقًا للتعليمات. لضمان أفضل تأثير ، يجب وضع جميع مكونات التفاعل على الجليد ويجب إجراء تحضير نظام التفاعل بعد التبريد الكامل. بعد اكتمال التحضير ، يرجى النقر أو الماصة للخلط جيدًا. لا دوامة!
1. طريقة الخلط غير الصحيحة (الدوامة ، التذبذب العنيف ، إلخ) سوف تتسبب في توزيع غير طبيعي لأجزاء المكتبة (كما هو موضح في الشكل التالي) ، مما يؤثر على جودة المكتبة. لذلك ، عند تحضير محلول تفاعل Fragmentation Mix ، يرجى الماصة بلطف لأعلى ولأسفل للخلط ، أو استخدم طرف الإصبع للنقر والخلط بالتساوي. احرص على عدم الاختلاط بالدوامة.

2. يجب استخدام الحمض النووي عالي النقاء لبناء المكتبة
■ سلامة الحمض النووي جيدة: نطاق الرحلان الكهربائي أكثر من 30 كيلو بايت ، بدون مخلفات
■ OD260 / 230:> 1.5
■ OD260 / 280: 1.7-1.9
3. يجب أن تكون كمية إدخال الحمض النووي دقيقة. يُقترح استخدام طرق Qubit و PicoGreen لتحديد كمية الحمض النووي ، بدلاً من Nanodrop.
4. يجب تحديد محتوى EDTA في محلول DNA. إن EDTA له تأثير كبير على تفاعل التجزئة. إذا كان محتوى EDTA مرتفعًا ، فيجب إجراء تنقية الحمض النووي قبل الاختبار التالي.
5. يجب تحضير محلول تفاعل التجزئة على الجليد. تكون عملية التجزئة حساسة لدرجة حرارة التفاعل والوقت (خاصة بعد إضافة المُحسِّن). من أجل ضمان دقة وقت التفاعل ، يرجى تحضير نظام التفاعل على الجليد.
6. يجب أن يكون وقت تفاعل التجزئة دقيقًا. سيؤثر وقت رد الفعل لخطوة التجزئة بشكل مباشر على حجم منتجات الأجزاء ، مما يؤثر على توزيع حجم أجزاء الحمض النووي في المكتبة.
1. ما هو نوع العينة المطبق على هذه المجموعة؟
يمكن أن يكون نوع العينة المطبق من هذه المجموعة هو RNA الكلي أو mRNA المنقى مع سلامة RNA جيدة. إذا تم استخدام إجمالي الحمض النووي الريبي لإنشاء المكتبة ، فمن المستحسن استخدام مجموعة استنفاد الرنا الريباسي (Cat # 4992363/4992364/4992391) لإزالة الرنا الريباسي أولاً.
2. هل يمكن استخدام عينات FFPE لإنشاء مكتبة باستخدام هذه المجموعة؟
سوف يتدهور mRNA في عينات FFPE إلى حد معين ، مع تكامل ضعيف نسبيًا. عند استخدام هذه المجموعة لبناء المكتبة ، يوصى بتحسين وقت التجزئة (تقصير وقت التجزئة أو عدم إجراء التجزئة).
3. باستخدام خطوة اختيار الحجم الواردة في دليل المنتج ، ما الذي قد يتسبب في ظهور انحراف طفيف في المقطع الذي تم إدخاله؟
يجب أن يتم اختيار الحجم بما يتفق بدقة مع خطوة اختيار الحجم في دليل المنتج هذا. إذا كان هناك انحراف ، فقد يكون السبب هو أن الحبيبات المغناطيسية غير متوازنة مع درجة حرارة الغرفة أو لم تختلط تمامًا ، أو أن الماصة ليست دقيقة أو أن السائل بقي في الطرف. يوصى باستخدام النصائح ذات الامتصاص المنخفض للتجربة.
4. اختيار المحولات في بناء المكتبة
لا تحتوي مجموعة بناء المكتبة على كاشف محول ، ويوصى باستخدام هذه المجموعة مع محول TIANSeq أحادي الفهرس (Illumina) (4992641/4992642/4992378).
5. مراقبة الجودة للمكتبة
الكشف الكمي للمكتبة: يستخدم Qubit و qPCR لتحديد تركيز الكتلة والتركيز المولي للمكتبة على التوالي. العملية تتوافق بدقة مع دليل المنتج. سوف يلبي تركيز المكتبة بشكل عام متطلبات تسلسل NGS. الكشف عن نطاق توزيع المكتبة: استخدام Agilent 2100 Bioanalyzer لاكتشاف نطاق توزيع المكتبة.
6. اختيار رقم دورة التضخيم
وفقًا للتعليمات ، فإن عدد دورات PCR هو 6-12 ، ويجب تحديد عدد دورات PCR اللازمة وفقًا لإدخال العينة. في المكتبات عالية الإنتاجية ، يحدث التضخيم الزائد عادةً بدرجات متفاوتة ، والذي يتجلى من خلال ذروة أكبر قليلاً بعد ذروة النطاق المستهدف في اكتشاف Agilent 2100 Bioanalyzer ، أو أن التركيز المكتشف لـ Qubit أقل من تركيز qPCR. التضخيم الخفيف هو ظاهرة طبيعية لا تؤثر على تسلسل المكتبة وتحليل البيانات اللاحق.
7. تظهر المسامير في ملف تعريف الكشف للمحلل الحيوي Agilent 2100
إن ظهور المسامير في كشف Agilent 2100 Bioanalyzer هو بسبب التجزئة غير المتكافئة للعينات ، حيث سيكون هناك المزيد من الشظايا في حجم معين ، وسيصبح هذا أكثر وضوحًا بعد تخصيب PCR. في هذه الحالة ، يُقترح عدم إجراء اختيار الحجم ، أي ضبط حالة التجزئة على 94 درجة مئوية لمدة 15 دقيقة حضانة ، حيث يكون توزيع الشظايا صغيرًا ومركّزًا ، ويمكن تحسين التجانس.
فئات المنتجات
لماذا أخترتنا
منذ إنشائه ، يقوم مصنعنا بتطوير منتجات عالمية المستوى مع الالتزام بالمبدأ
الجودة أولا. اكتسبت منتجاتنا سمعة ممتازة في الصناعة والثقة القيمة بين العملاء الجدد والقدامى.








